- Un cilindro a pareti adiabatiche e
munito di pistone, anch’esso isolante, è diviso in due parti
uguali da un setto. Inizialmente il pistone è bloccato e la parte
inferiore, di volume V1 = 2 l, contiene 0.4 moli di gas
perfetto monoatomico alla temperatura T1 = 27 °C, mentre
nella parte superiore vi è il vuoto. (a) Viene rimosso il setto ed
il gas si espande liberamente. Determinare lo stato finale del gas
(valori di pressione, volume e temperatura) e la variazione di
entropia del gas. (b) Successivamente viene sbloccato il pistone e
il gas viene compresso in modo reversibile fino a riportarlo al
volume iniziale. Di che tipo di trasformazione si tratta ?
Determinare la temperatura e la pressione del gas in questo stato e
il lavoro fatto dal gas.
|
 |
- Un fluido termodinamico esegue un
ciclo di Carnot (reversibile) operando tra due sorgenti le cui
temperature differiscono di 200 K. La variazione di entropia lungo
la trasformazione isoterma alla temperatura inferiore è
ΔS1 = -20 cal/K. Calcolare il lavoro compiuto nel
ciclo.
|
 |
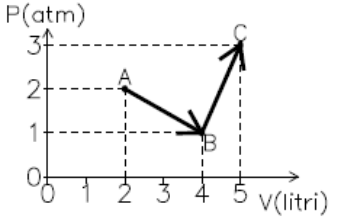
- Una quantità
di gas ideale monoatomico corrispondente a 0.2 moli compie
la trasformazione indicata in figura. Calcolare:
- le temperature TA , TB e
TC ;
- la variazione complessiva di energia interna in
corrispondenza della trasformazione;
- il lavoro totale compiuto dal gas;
- il calore complessivamente assorbito dal gas.
|
 |
|
 |
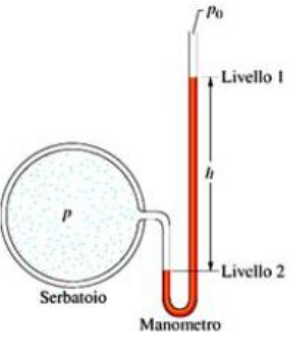
- Un manometro
a tubo aperto è uno strumento che serve per misurare la
pressione di un gas contenuto all'interno di un serbatoio.
Il manometro è costituito da un tubo ad U contenente un
liquido di densità ρ. Una estremità del tubo è
collegata al serbatoio e l'altra è aperta in atmosfera alla
pressione p0 = 1 atm. Supponendo che il liquido
sia mercurio (ρ = 13.6 g/cm3 ), calcolare
l'altezza h nei casi in cui p = 2.5 atm e in cui p = 0.5
atm. Supponiamo che inizialmente il gas abbia una pressione
p = p0 e si trovi a temperatura ambiente
(tA = 25 °C). Quanto sarà h se si riscalda il
gas fino ad una temperatura di 100 °C (trascurare il volume
del gas nel tubo).
|
 |
|
 |
- Una mole di gas perfetto monoatomico
descrive un ciclo reversibile la cui forma nel piano pV è un
triangolo. I dati sono: pA = pB = 1 atm,
pC = 0,2 atm; VA = 10-2
m3 , VB = 3⋅10 -2
m3 , VC = 4⋅10-2
m3 .
- Calcolare il lavoro compiuto dal gas in un ciclo e il
rendimento del ciclo.
- Quale sarebbe il rendimento di un ciclo di Carnot che
lavorasse tra le temperature TA e TB
?
|
 |
- Calcolare la variazione di energia
interna e la variazione di entropia che subiscono 150 g di azoto
(N2 , peso molecolare 28) nel passare dalla pressione di
1 atm e temperatura di 10 °C fino allo stato cui corrisponde un
volume di 200 dm3 , lungo una trasformazione del tipo
pV1.5 = costante.
|
 |
- Due moli di gas ideale monoatomico si
espandono in modo adiabatico reversibile, fino ad occupare un
volume triplo di quello iniziale. La temperatura iniziale vale
TA = 300 K. Determinare il lavoro compiuto durante
l’espansione
|
 |
- Un recipiente a pareti adiabatiche è
diviso in due parti uguali da un pistone di materiale adiabatico e
massa trascurabile, che può scorrere senza attrito. In una delle
due parti è contenuta una mole di gas ideale monoatomico mentre
nell'altra si è fatto il vuoto. La temperatura iniziale del gas è
T1 = 300 K. Si sblocca il pistone e il gas compie
un’espansione libera fino a occupare l’intero volume
del cilindro. Successivamente il pistone viene riportato lentamente
(cioè reversibilmente) nella posizione iniziale. Determinare,
relativamente all’intero processo: (i) la variazione di
entropia; (ii) la variazione di energia interna.
|
 |
- Una mole di gas ideale si trova a
contatto con una sorgente termica a 350 K e ad una pressione di 10
atm. La pressione viene lentamente aumentata fino a 25 atm.
Calcolare: a) il volume iniziale e finale del gas; b) il lavoro
compiuto sul gas; c) la variazione di energia interna; d) la
quantità di calore scambiato.
|
 |
- Un gas ideale monoatomico si trova in
uno stato iniziale a temperatura TA = 1000 K, volume
VA = 0,1 m3 e pressione pA =
106 N/m2 . Si effettua una prima
trasformazione isocora fino a pressione p B =
3∙105 N/m2 , poi una seconda che,
mantenendo costante la pressione porta il gas ad un volume
VC = 0,25 m3 . Determinare il lavoro compiuto
dal gas, il calore scambiato e la variazione di energia interna del
gas in corrispondenza dell’intera trasformazione.
|
 |











